You are using an out of date browser. It may not display this or other websites correctly.
You should upgrade or use an alternative browser.
You should upgrade or use an alternative browser.
Cerveja Sem Álcool
- Thread starter orube
- Start date

Help Support Homebrew Talk - Beer, Wine, Mead, & Cider Brewing Discussion Forum:
This site may earn a commission from merchant affiliate
links, including eBay, Amazon, and others.
dcunhamaciel
Well-Known Member
- Joined
- Jul 30, 2015
- Messages
- 324
- Reaction score
- 48
Não li, até porque meu inglês é horrível, mas tá ai:
http://byo.com/body/item/263-brew-a-great-non-alcoholic-beer
http://byo.com/body/item/263-brew-a-great-non-alcoholic-beer
jeanpaullopes
Well-Known Member
- Joined
- May 17, 2016
- Messages
- 1,824
- Reaction score
- 737
Pelo que eu já li, basicamente é fazer a cerveja e após a fermentação e maturação aquece-la para que o álcool evapore (há uma temperatura certa para isto).
Após ou se carbonata forçado (mais próximo de 0% de álcool) ou se inocula novo fermento (o antigo morreu no aquecimento) e o primming, dando no final por volta de 0,5% de graduação alcoólica.
Após ou se carbonata forçado (mais próximo de 0% de álcool) ou se inocula novo fermento (o antigo morreu no aquecimento) e o primming, dando no final por volta de 0,5% de graduação alcoólica.
NH3
Well-Known Member
- Joined
- Dec 18, 2015
- Messages
- 152
- Reaction score
- 67
Com certeza, aquecer é o mais simples. Separei 2 L de cerveja de uma batelada de 20 L, aqueci a por um bom tempo a 65 oC, e já estão engarrafadas carbonatando com priming. Porém, imagino que muito do aroma se perdeu, e talvez tenha havido algumas reações indesejáveis. Pretendo experimental daqui a uma semana.
Alguém já tentou outra forma que não seja aquecimento a temperaturas acima de 60 oC?
Alguém já tentou outra forma que não seja aquecimento a temperaturas acima de 60 oC?
GuilhermeCunha
Well-Known Member
- Joined
- Jul 31, 2015
- Messages
- 145
- Reaction score
- 46
Pessoal,
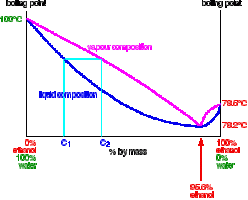
Acredito que aquecer não é a solução. Para aqueles que tem formação em química: a mistura água + álcool forma algo que chamamos de azeotropo. O azeotropo é um ponto da mistura em que ambos água e álcool vão evaporar juntos sem variar a composição.
E qual é este ponto? Resposta: 95,6% água | 4,4% de álcool.
Exemplo 1:
Cerveja com 7% álcool inicia fervura, ao aquecer e chegar neste ponto (4,4% Álcool), a mistura vai continuar evaporando a com esta razão dos componentes até secar completamente. Ou seja, o máximo que vamos conseguir é 4,4% de álcool.
Exemplo 2: E se a cerveja já tiver uma quantidade de álcool abaixo de 4,4%?
Acontecerá o mesmo fenômeno no sentido inverso. A mistura digamos com 3% de álcool entra em ebulição, e a evaporação concentrará a mistura até 4,4% novamente, e dai segue a lógica anterior.
Saliento que isto que expliquei ocorre em misturas de apenas os dois compostos (água + etanol), mas que na cerveja, apesar de existirem bem mais componentes, deve ainda apresentar este comportamento.
Guilherme
Acredito que aquecer não é a solução. Para aqueles que tem formação em química: a mistura água + álcool forma algo que chamamos de azeotropo. O azeotropo é um ponto da mistura em que ambos água e álcool vão evaporar juntos sem variar a composição.
E qual é este ponto? Resposta: 95,6% água | 4,4% de álcool.
Exemplo 1:
Cerveja com 7% álcool inicia fervura, ao aquecer e chegar neste ponto (4,4% Álcool), a mistura vai continuar evaporando a com esta razão dos componentes até secar completamente. Ou seja, o máximo que vamos conseguir é 4,4% de álcool.
Exemplo 2: E se a cerveja já tiver uma quantidade de álcool abaixo de 4,4%?
Acontecerá o mesmo fenômeno no sentido inverso. A mistura digamos com 3% de álcool entra em ebulição, e a evaporação concentrará a mistura até 4,4% novamente, e dai segue a lógica anterior.
Saliento que isto que expliquei ocorre em misturas de apenas os dois compostos (água + etanol), mas que na cerveja, apesar de existirem bem mais componentes, deve ainda apresentar este comportamento.
Guilherme
Attachments
Pessoal,
Acredito que aquecer não é a solução. Para aqueles que tem formação em química: a mistura água + álcool forma algo que chamamos de azeotropo. O azeotropo é um ponto da mistura em que ambos água e álcool vão evaporar juntos sem variar a composição.
E qual é este ponto? Resposta: 95,6% água | 4,4% de álcool.
Exemplo 1:
Cerveja com 7% álcool inicia fervura, ao aquecer e chegar neste ponto (4,4% Álcool), a mistura vai continuar evaporando a com esta razão dos componentes até secar completamente. Ou seja, o máximo que vamos conseguir é 4,4% de álcool.
Exemplo 2: E se a cerveja já tiver uma quantidade de álcool abaixo de 4,4%?
Acontecerá o mesmo fenômeno no sentido inverso. A mistura digamos com 3% de álcool entra em ebulição, e a evaporação concentrará a mistura até 4,4% novamente, e dai segue a lógica anterior.
Saliento que isto que expliquei ocorre em misturas de apenas os dois compostos (água + etanol), mas que na cerveja, apesar de existirem bem mais componentes, deve ainda apresentar este comportamento.
Guilherme
Isso realmente é verdade! Mas o mosto não é água...às vezes os açúcares não fermentáveis podem 'quebrar' este azeótropo...alguém tem noção de como é feito na indústria?
Eu chuto que pode ser feita uma lavagem com algum componente que a água não seja miscível e o álcool seja miscível ou até mesmo adicionar outro componente para quebrar o azeótropo...
GuilhermeCunha
Well-Known Member
- Joined
- Jul 31, 2015
- Messages
- 145
- Reaction score
- 46
Sim isso mesmo, existem processo de quebra do azeotropo (eu não estudei nenhum então não sei explicar aqui), por isso inclusive falei que não sei o comportamento fora da mistura ideal (água + álcool). Mas acredito que o aquecimento simples não resolva.
Guilherme
Guilherme
Sim isso mesmo, existem processo de quebra do azeotropo (eu não estudei nenhum então não sei explicar aqui), por isso inclusive falei que não sei o comportamento fora da mistura ideal (água + álcool). Mas acredito que o aquecimento simples não resolva.
Guilherme
Agora que lembrei...talvez variando a pressão para um ponto que não haja formação de azeótropo você consiga realizar o aquecimento para evaporar todo o alcool...
GuilhermeCunha
Well-Known Member
- Joined
- Jul 31, 2015
- Messages
- 145
- Reaction score
- 46
Realmente não sei, acho que só pressão não muda nada neste caso. Enfim, o artigo citado no inicio do post fala em aquecimento, e a cerveja ficará com muito baixo teor alcoolico, o que deve ser suficiente. Agora as cervejas 0% ABV devem usar algum tipo de produto para quebrar o azeotropo, dando uma lida rapida na internet, algumas industrias (não alimenticias) utilizam sais dissolvidos para este fim.
Para cervejas, eu realmente acredito que façam cervejas com muito baixo teor alcoolico ja na receita, e depois mais algum processo de aquecimento.
No mais, interessante o assunto, vou ler mais a respeito.
Para cervejas, eu realmente acredito que façam cervejas com muito baixo teor alcoolico ja na receita, e depois mais algum processo de aquecimento.
No mais, interessante o assunto, vou ler mais a respeito.
juanchristian
Well-Known Member
- Joined
- Apr 28, 2015
- Messages
- 241
- Reaction score
- 59
juanchristian
Well-Known Member
- Joined
- Apr 28, 2015
- Messages
- 241
- Reaction score
- 59
ou assim:
http://www.tudogostoso.com.br/receita/56724-cerveja-caseira-sem-alcool-receita-da-vovo.html
kkkkkkkkkkkkkkkkkkkkk
http://www.tudogostoso.com.br/receita/56724-cerveja-caseira-sem-alcool-receita-da-vovo.html
kkkkkkkkkkkkkkkkkkkkk
GuilhermeCunha
Well-Known Member
- Joined
- Jul 31, 2015
- Messages
- 145
- Reaction score
- 46
NH3
Well-Known Member
- Joined
- Dec 18, 2015
- Messages
- 152
- Reaction score
- 67
Pessoal,
Acredito que aquecer não é a solução. Para aqueles que tem formação em química: a mistura água + álcool forma algo que chamamos de azeotropo. O azeotropo é um ponto da mistura em que ambos água e álcool vão evaporar juntos sem variar a composição.
E qual é este ponto? Resposta: 95,6% água | 4,4% de álcool.
Exemplo 1:
Cerveja com 7% álcool inicia fervura, ao aquecer e chegar neste ponto (4,4% Álcool), a mistura vai continuar evaporando a com esta razão dos componentes até secar completamente. Ou seja, o máximo que vamos conseguir é 4,4% de álcool.
Exemplo 2: E se a cerveja já tiver uma quantidade de álcool abaixo de 4,4%?
Acontecerá o mesmo fenômeno no sentido inverso. A mistura digamos com 3% de álcool entra em ebulição, e a evaporação concentrará a mistura até 4,4% novamente, e dai segue a lógica anterior.
Saliento que isto que expliquei ocorre em misturas de apenas os dois compostos (água + etanol), mas que na cerveja, apesar de existirem bem mais componentes, deve ainda apresentar este comportamento.
Guilherme
A sua crença está equivocada, pois há um erro de interpretação da figura que postou. A figura que postou é utilizada para explicar as limitações do processo de destilação onde busca-se aumentar a concentração de etanol e no caso desse tópico, buscamos formas de reduzir a quantidade de etanol. Na pressão atmosférica (101,3 kPa), etanol e água formam uma mistura azeotrópica quando a porcentagem de água na fase líquida é 4,4 % e a porcentagem de etanol é 95,6%, e não o contrário. Logo, você não consegue concentrar a sua cerveja (ou qualquer outra mistura alcoólica com etanol) para atingir mais de 95,6 % de álcool por destilação simples, pois essa concentração de fase líquida e a mesma da fase vapor.
Se tirou a figura do site http://www.chemguide.co.uk/physical/phaseeqia/nonideal.html, leia até o final onde o autor menciona que começando com uma solução abaixo de 95.6% em massa de etanol, chega-se em água pura no reservatório que continha a solução original.
Uma vez explicado porque há um equívoco na sua crença, voltamos a questão de como produzir uma boa cerveja sem álcool. Cervejas, de modo geral, têm mais de 3 % e menos de 8 % de álcool em base mássica, e é possível retirar o álcool da cerveja ou de qualquer outra bebida alcoólica através da vaporização do álcool. O problema é que tanto álcool quanto água (e outras substâncias voláteis) vão evaporar, e a quantidade de cada um que vai evaporar depende da pressão de vapor da fase alcóolica e da pressão de vapor da fase aquosa. Se alguém dúvida que que água e álcool vão vaporizar inclusive na temperatura ambiente, basta deixar um copo de cerveja em cima da mesa (com uma tela para evitar que caia algum inseto) e notará, que após algum tempo, todo álcool terá evaporado e após mais um tempo, só terá sobrado apenas extrato.
Como tanto o álcool quanto a água vão sair na fase vapor, é importante estimar quanto de água tem que ser evaporada, para se conseguir evaporar uma certa quantidade de álcool.
A temperatura e pressão da cerveja vão influenciar apenas o tempo que o processo vai acontecer e a proporção de água que tem que ser evaporada para se evaporar uma certa quantidade de álcool.
Através das informações fornecidas por este site (http://vle-calc.com/phase_diagram.html), calculei que para uma cerveja com concentração alcoólica inicial de 4 % em base mássica, na temperatura de 30 oC, eu consigo chegar a uma cerveja com 0.2 % de álcool em base mássica, se eu evaporar 27 % do volume inicial. Na temperatura de 60 oC, é necessário evaporar cerca de 26 % e na temperatura de 100 oC, é necessário evaporar cerca de 18 % do volume inicial.
Claro que quanto menor a temperatura, maior o tempo (a 30 oC, provavelmente vai levar dias), entre 60-65 oC, levou cerca de algumas horas. E quanto maior o tempo do processo, maior a chance de ocorrer, não apenas perda de voláteis, mas também a ocorrência de alguma reação indesejável.
E o que estou buscando com esse tópico, e trocar informações com pessoas que já tentaram diferentes combinações de tempo-temperatura para remover o álcool da cerveja, e descobrir em qual combinação, minimiza-se as alterações de aroma e sabor. Também pretendo refazer um teste utilizando uma bomba de vácuo a água, pois na primeira tentativa que fiz, foi um desastre. Não retirei todo o CO2, e quando a cerveja entrou em ebulição a 30 oC, ela subiu como leite no fogão e bagunçou a tubulação da bomba de vácuo. Portanto, caso mais alguém queira utilizar vácuo para retirar o álcool, não esqueça de primeiramente, retirar todo o CO2 da cerveja (e claro, utilize bombas de vácuo a água e não aquelas a óleo, utilizadas na instalação de ar condicionado).
Falando em cervejas sem alcool:
http://brasil.estadao.com.br/notici...de-se-dizer-sem-alcool-decide-stj,10000084254
http://brasil.estadao.com.br/notici...de-se-dizer-sem-alcool-decide-stj,10000084254
GuilhermeCunha
Well-Known Member
- Joined
- Jul 31, 2015
- Messages
- 145
- Reaction score
- 46
A sua crença está equivocada, pois há um erro de interpretação da figura que postou. A figura que postou é utilizada para explicar as limitações do processo de destilação onde busca-se aumentar a concentração de etanol e no caso desse tópico, buscamos formas de reduzir a quantidade de etanol. Na pressão atmosférica (101,3 kPa), etanol e água formam uma mistura azeotrópica quando a porcentagem de água na fase líquida é 4,4 % e a porcentagem de etanol é 95,6%, e não o contrário. Logo, você não consegue concentrar a sua cerveja (ou qualquer outra mistura alcoólica com etanol) para atingir mais de 95,6 % de álcool por destilação simples, pois essa concentração de fase líquida e a mesma da fase vapor.
Se tirou a figura do site http://www.chemguide.co.uk/physical/phaseeqia/nonideal.html, leia até o final onde o autor menciona que começando com uma solução abaixo de 95.6% em massa de etanol, chega-se em água pura no reservatório que continha a solução original.
Uma vez explicado porque há um equívoco na sua crença, voltamos a questão de como produzir uma boa cerveja sem álcool. Cervejas, de modo geral, têm mais de 3 % e menos de 8 % de álcool em base mássica, e é possível retirar o álcool da cerveja ou de qualquer outra bebida alcoólica através da vaporização do álcool. O problema é que tanto álcool quanto água (e outras substâncias voláteis) vão evaporar, e a quantidade de cada um que vai evaporar depende da pressão de vapor da fase alcóolica e da pressão de vapor da fase aquosa. Se alguém dúvida que que água e álcool vão vaporizar inclusive na temperatura ambiente, basta deixar um copo de cerveja em cima da mesa (com uma tela para evitar que caia algum inseto) e notará, que após algum tempo, todo álcool terá evaporado e após mais um tempo, só terá sobrado apenas extrato.
Como tanto o álcool quanto a água vão sair na fase vapor, é importante estimar quanto de água tem que ser evaporada, para se conseguir evaporar uma certa quantidade de álcool.
A temperatura e pressão da cerveja vão influenciar apenas o tempo que o processo vai acontecer e a proporção de água que tem que ser evaporada para se evaporar uma certa quantidade de álcool.
Através das informações fornecidas por este site (http://vle-calc.com/phase_diagram.html), calculei que para uma cerveja com concentração alcoólica inicial de 4 % em base mássica, na temperatura de 30 oC, eu consigo chegar a uma cerveja com 0.2 % de álcool em base mássica, se eu evaporar 27 % do volume inicial. Na temperatura de 60 oC, é necessário evaporar cerca de 26 % e na temperatura de 100 oC, é necessário evaporar cerca de 18 % do volume inicial.
Claro que quanto menor a temperatura, maior o tempo (a 30 oC, provavelmente vai levar dias), entre 60-65 oC, levou cerca de algumas horas. E quanto maior o tempo do processo, maior a chance de ocorrer, não apenas perda de voláteis, mas também a ocorrência de alguma reação indesejável.
E o que estou buscando com esse tópico, e trocar informações com pessoas que já tentaram diferentes combinações de tempo-temperatura para remover o álcool da cerveja, e descobrir em qual combinação, minimiza-se as alterações de aroma e sabor. Também pretendo refazer um teste utilizando uma bomba de vácuo a água, pois na primeira tentativa que fiz, foi um desastre. Não retirei todo o CO2, e quando a cerveja entrou em ebulição a 30 oC, ela subiu como leite no fogão e bagunçou a tubulação da bomba de vácuo. Portanto, caso mais alguém queira utilizar vácuo para retirar o álcool, não esqueça de primeiramente, retirar todo o CO2 da cerveja (e claro, utilize bombas de vácuo a água e não aquelas a óleo, utilizadas na instalação de ar condicionado).
@NH3 parabéns pela explicação, na verdade não é uma crença minha, mas realmente estou enferrujado no assunto, já fazem 10 anos que me formei e nunca mais utilizei este conhecimento (fica a dica para eu ler com mais atenção). A desatenção foi tão grande que li e reli o ponto no gráfico como 95,6% de água.
No mais, não tenho nada a acrescentar na tua explicação.

Grande abraço,
Guilherme